유해균
유해균은 생태계에 불균형(Dysbiosis)을 초래하고, 염증을 유발하여 만성적인 질병을 일으키는 미생물이다. 유해균은 병원성 미생물 혹은 기회감염균에 한정적인 개념이었으나, 분자생물학적인 분석법이 발달하고 미생물을 생태적으로 해석하기 시작하면서 불균형을 일으키거나 불균형 상태에서 증식하는 종류, 즉, 공생 유해균(Pathobiont)의 중요성이 대두되었다. 공생 유해균은 만성적인 염증과 관련되어 있어, 불균형의 지표종이자 현대 질병의 지표종으로 볼 수 있다.
유해균의 종류
유해균의 종류는 아래와 같다. 각 항목은 대표적인 특징에 관한 것으로, 대부분의 유해균은 비슷한 특징을 가진다. 모든 감염 메커니즘은 염증 유발 과정을 동반한다고 볼 수 있고, 염증을 유발하는 미생물은 염증과 관련된 다양한 질병과 관련되어 있다고도 해석할 수 있다.(단, 감염성 미생물은 일시적으로 염증을 유발하는 미생물 종류이다.)
- 염증 반응 및 질병 유발
- Proteobacteria: 대표 감염균, 공생 유해균(Pathobiont), 기회 감염균 등을 포함하는 거대한 분류군(Phylum)으로서, 불균형 상태를 대표하는 지표 미생물들이 많이 포함되어 있음1
- Enterobacteriaceae, Escherichia, Shigella, Klebsiella, Salmonella, Enterobacter 등: 공생 유해균, 감염균, 기회 감염균
- Fusobacterium: 대장암 유발(염증 유발)2, 바이오필름 생성
- Proteobacteria: 대표 감염균, 공생 유해균(Pathobiont), 기회 감염균 등을 포함하는 거대한 분류군(Phylum)으로서, 불균형 상태를 대표하는 지표 미생물들이 많이 포함되어 있음1
- 항생제 내성
- Enterococcus: 항생제 내성 유전자 발견3,4
- 감염(전통적인 유해균)
- Clostridium difficile: 항생제 복용 후 설사 유발
- Salmonella: 식중독, 설사 유발
- Vibrio: 식중독, 급성 설사 유발
- 기회 감염
- Haemophilus, Corynebacterium, Campylobacter, Pseudomonas 등: 환경에 따라 감염5(평소보다 많이 발견 시 감염을 의심)
유해균의 감염 메커니즘과 상주 미생물의 유해균 억제 메커니즘
장내 미생물은 인간과 함께 공존하며, 장 상피 세포벽 강화, 면역계 발달, 영양소 흡수 등 숙주의 생리학적 과정에 필수적인 역할을 한다. 장내 미생물 군집의 가장 강력하고도 중요한 기능은 유해균을 정착하지 못하게 하거나, 유해균의 성장을 억제하여 숙주를 보호하는 역할이다. 병원체를 억제하는 메커니즘은 아주 복잡한데, 크게 보면 1) 대사적인 경쟁력을 가져가는 것, 2) 장 상피 세포벽의 틈새를 메우는 것, 3) 숙주의 면역 반응을 유도하는 것이다.5
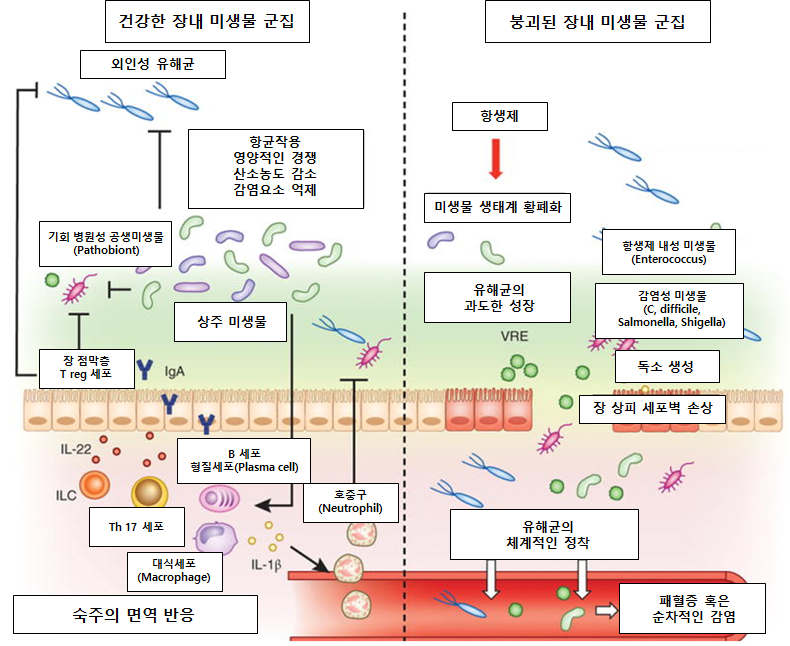
붕괴된 장내 미생물 군집 내에서의 유해균의 작용
유해균 지수
천랩의 유해균 지수는 GMI(Gut Microbiome Index) 계산에 사용되는 지수 중 하나로, 유해균과 상주균의 비율을 통해 계산한다. 상주균이 충분히 있으면 면역 조절 등의 메커니즘으로 유해균을 억제하므로, 유해균의 유효성을 상주균과의 비율로 도출한다. 유해균 지수의 계산에 사용하는 미생물은 다음과 같다. 지수화는 불균형 상태를 규정하는 논문의 컨셉에 따른다.6
- 유해균(Pathobiont): Enterobacteriaceae, Fusobacteriaceae, Enterococcaceae 등 염증을 유발하는 family. 주로 Proteobacteria에 속함.
- 상주균(Commensal): Bacteroidales, Lachnospiraceae, Ruminococcaceae, Bifidobacteriaceae 등 장내에서 우세한 family.
References
- 1.Shin N-R, Whon TW, Bae J-W. Proteobacteria: microbial signature of dysbiosis in gut microbiota. Trends in Biotechnology. September 2015:496-503. doi:10.1016/j.tibtech.2015.06.011
- 2.Bullman S, Pedamallu CS, Sicinska E, et al. Analysis of Fusobacterium persistence and antibiotic response in colorectal cancer. Science. November 2017:1443-1448. doi:10.1126/science.aal5240
- 3.Unban K, Kanpiengjai A, Takata G, Uechi K, Lee W-C, Khanongnuch C. Amylolytic Enzymes Acquired from L-Lactic Acid Producing Enterococcus faecium K-1 and Improvement of Direct Lactic Acid Production from Cassava Starch. Appl Biochem Biotechnol. February 2017:155-170. doi:10.1007/s12010-017-2436-1
- 4.Guo Y, Tomich AD, McElheny CL, et al. High-Level Fosfomycin Resistance in Vancomycin-Resistant Enterococcus faecium. Emerg Infect Dis. November 2017:1902-1904. doi:10.3201/eid2311.171130
- 5.Kamada N, Chen GY, Inohara N, Núñez G. Control of pathogens and pathobionts by the gut microbiota. Nat Immunol. June 2013:685-690. doi:10.1038/ni.2608
- 6.Gevers D, Kugathasan S, Denson LA, et al. The Treatment-Naive Microbiome in New-Onset Crohn’s Disease. Cell Host & Microbe. March 2014:382-392. doi:10.1016/j.chom.2014.02.005

